

2018年,在推动创新药物研发方面,备受关注的药品试验数据保护制度、接受药品境外临床试验数据的技术指导原则的通告、临床试验申请默认制等政策陆续出台。《药品试验数据保护实施办法(暂行)(征求意见稿)》、《接受药品境外临床试验数据的技术指导原则》、《关于调整药物临床试验审评审批程序的公告》等一系列政策的发布对于激发国内新药研发热情,缩短创新药物临床开发时间,加速境外新药上市,倒逼国内企业新药研发进程等有积极的推动作用。
图表2:2018年以来中国药品研发相关政策汇总分析
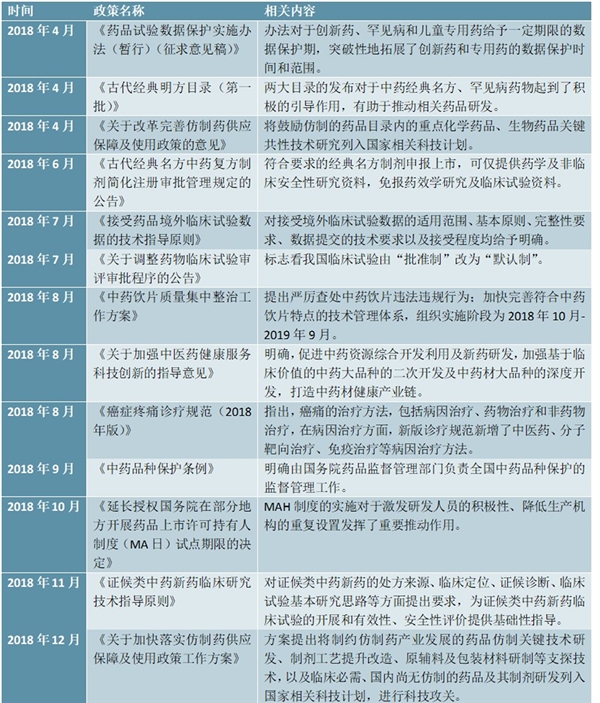
资料来源:锐观咨询整理

锐观网倡导尊重与保护知识产权。如发现本站文章存在版权问题,烦请联系service@reportrc.com、010-5716921,我们将及时沟通与处理。
